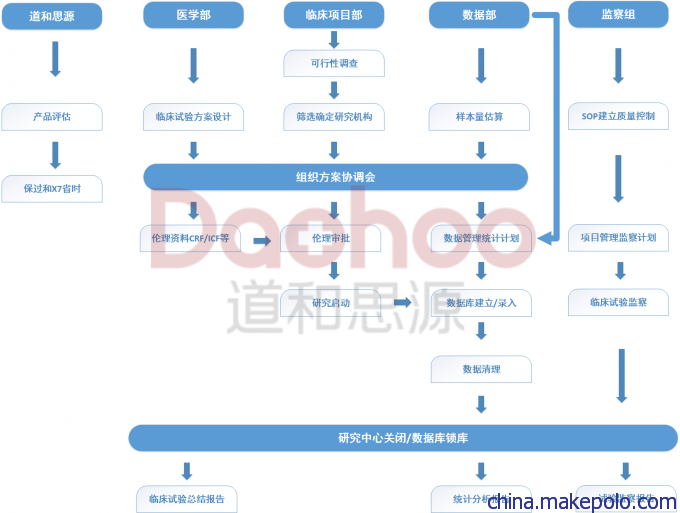
按照法规要求,医疗器械注册临床试验必须由CRA(临床试验监查员)进行监查,临床试验监查的目的包括:保证临床试验中受试者的权益受到保障,保证试验记录与报告的数据准确、完整无误,保证试验遵循已批准的方案和有关法规进行。
道和思源提供高质量专业医疗器械临床试验监查服务。通过经验丰富的项目经理带领的专业CRA组成的临床试验监查团队,确保项目高质量并且合规的完成.
道和思源为客户提供:1. 在试验前确认试验承担单位具有适当的条件,包括人员配备与培训情况,实验室设备齐全、运转良好,具备各种与试验有关的检查条件,估计有足够数量的受试者,参与研究人员熟悉试验方案中的要求;
2. 在试验过程中监查研究者对试验方案的执行情况,确认在试验前取得所有受试者的知情同意书,了解受试者的入选率及试验的进展状况,确认入选的受试者合格;


3. 确认所有数据的记录与报告正确完整,所有病例报告表填写正确,并与原始资料一致。所有错误或遗漏均已改正或注明,经研究者签名并注明日期。每一受试者的治疗变更、合并治疗、间发疾病、失访、检查遗漏等均应确认并记录。核实入选受试者的退出与失访已在病例报告表中予以说明;
4. 确认所有不良事件均记录在案,严重不良事件在规定时间内作出报告并记录在案;
5. 核实试验用产品及对照品按照有关法规进行供应、储藏、分发、收回,并做相应的记录;
6. 协助研究者进行必要的通知及申请事宜,向申办者报告试验数据和结果;
7. 应清楚如实记录研究者未能做到的随访、未进行的试验、未做的检查,以及是否对错误、遗漏作出纠正;
8. 每次访视后作出书面报告递送申办者,报告应述明监查日期、时间、监查员姓名、监查的发现等。
收费标准此项服务根据客户的需求定制临床研究,因产品不同、目的不同,研究复杂程度及规模差异很大,请留下您的联系方式,我们的医学顾问将联系您进行项目评估及报价,如需陪同上会服务,请向医学顾问提出。